|

Propietats |
| Nombre atòmic: |
|
9 |
| Massa atòmica
relativa: |
|
18,9984 uma |
| Punt de fusió: |
|
53,6 K / –219,56 ºC |
| Punt d’ebullició: |
|
85 K / –188,16 ºC |
| Densitat: |
|
1516 kg m–3 (20 ºC) |
| Estats d’oxidació: |
|
–1 |
| Electronegativitat
(escala de Pauling): |
|
3,98 |
| Potencial d’ionització: |
|
17,42 eV |
| Configuració electrònica: |
|
[He]2s22p5 |
| Duresa
(escala de Mohs): |
|
— |
| Potencial normal de reducció: |
|
+ 2,87 V ½F2 | F– |
| Conductivitat tèrmica: |
|
0,03 J m–1 s–1 ºC–1 |
| Conductivitat elèctrica: |
|
0,0 mΩ–1 cm–1 |
| Calor específica: |
|
752,40 J kg–1 K–1 |
| Calor de fusió: |
|
1,0 kJ mol–1 |
| Calor d’evaporació: |
|
6,5 kJ mol–1 |
| Calor
d’atomització: |
|
79,0 kJ mol–1 |
| 1a
energia d’ionització: |
|
1681 kJ mol–1 |
| 2a
energia d’ionització: |
|
3374,1 kJ mol–1 |
| 3a
energia d’ionització: |
|
6050,3 kJ mol–1 |
| Afinitat electrònica: |
|
328 kJ mol–1 |
| Radi atòmic: |
|
0,57 Å |
| Radi covalent: |
|
0,72 Å |
| Radi iònic: |
|
F-1 = 1,31 Å |
|
F+7 = 0,07 Å |
|
— |
| Volum atòmic: |
|
17,1 cm³ mol–1 |
| Polaritzabilitat: |
|
0,6 ų |


Enllaços covalents
|
| F—F: |
|
159 kJ mol–1 |
| F—O: |
|
190 kJ mol–1 |
| F—N: |
|
272 kJ mol–1 |
| C—F: |
|
484 kJ mol–1 |

|

Fotografia del fluor

Henri Moissan
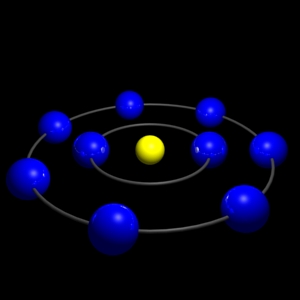
Àtom de fluor ( [He]2s22p5 ) |