|

Propietats |
| Nombre atòmic: |
|
17 |
| Massa atòmica
relativa: |
|
35,4527 uma |
| Punt de fusió: |
|
172,18 K / –100,98 ºC |
| Punt d’ebullició: |
|
239,2 K / –33,96 ºC |
| Densitat: |
|
2030 kg m–3 (20 ºC) |
| Estats d’oxidació: |
|
–1, +1, +2, +3, +4, +5, +6, +7 |
| Electronegativitat
(escala de Pauling): |
|
3,16 |
| Potencial d’ionització: |
|
12,97 eV |
| Configuració electrònica: |
|
[Ne]3s23p5 |
| Duresa
(escala de Mohs): |
|
— |
| Potencial normal de reducció: |
|
+1,36 V ½Cl2 | Cl– |
| Conductivitat tèrmica: |
|
0,01 J m–1 s–1 ºC–1 |
| Conductivitat elèctrica: |
|
0,0 mΩ–1 cm–1 |
| Calor específica: |
|
484,88 J kg–1 K–1 |
| Calor de fusió: |
|
6,4 kJ mol–1 |
| Calor d’evaporació: |
|
20,4 kJ mol–1 |
| Calor
d’atomització: |
|
121,0 kJ mol–1 |
| 1a
energia d’ionització: |
|
1251,1 kJ mol–1 |
| 2a
energia d’ionització: |
|
2297,3 kJ mol–1 |
| 3a
energia d’ionització: |
|
3821,8 kJ mol–1 |
| Afinitat electrònica: |
|
349 kJ mol–1 |
| Radi atòmic: |
|
0,97 Å |
| Radi covalent: |
|
0,99 Å |
| Radi iònic: |
|
Cl–1 = 1,81 Å |
|
Cl+7 = 0,26 Å |
|
— |
| Volum atòmic: |
|
22,7 cm³ mol–1 |
| Polaritzabilitat: |
|
2,2 ų |


Enllaços covalents
|
| Cl—O: |
|
206 kJ mol–1 |
| Cl—Cl: |
|
242 kJ mol–1 |
| Cl—F: |
|
257 kJ mol–1 |
| Cl—H: |
|
431 kJ mol–1 |

|

Fotografia del clor

Karl Wilhelm Scheele
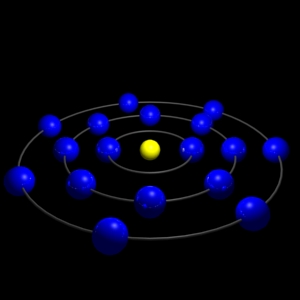
Àtom de clor ( [Ne]3s23p5 ) |